KaliDiv,Parasitoses intestinales
Les CQI pour le diagnostic des parasitoses intestinales sont proposés pour la maîtrise et le contrôle des techniques de coloration et de concentration des parasites dans les selles.
Pour les techniques de coloration, Kalidiv propose aux LBM :
Les CQI KD-Col/ParaMyco/Selles-Suspension (CQI KD-Col/PM/Susp) qui sont à utiliser pour la validation/vérification et le contrôle des principales techniques classiques de coloration des parasites dans les selles (MIF, colorant à base d’éosine et/ou de lugol, colorant à base de cristal violet, MGG). Ces CQI comprennent :
- Le CQI KD-Col/PM/Susp-E.h Fv : suspensions de selles avec des formes végétatives d’Entamoeba histolytica,
- Le CQI KD-Col/PM/Susp-E.hmd Fv : suspensions de selles avec des formes végétatives du groupe Entamoeba histolytica, E. moshkovskii et E. dispar,
- Le CQI KD-Col/PM/Susp-G.d Fv : suspensions de selles avec des formes végétatives de Giardia duodenalis,
- Le CQI KD-Col/PM/Susp-G.d K : suspensions de selles avec des kystes de Giardia duodenalis.
La fréquence d’utilisation des CQI KD-Col/ParaMyco/selles est définie par le biologiste. Il est conseillé́ de les utiliser pour chaque ouverture des kits pour les techniques de coloration permanente en tube (MIF ou autres colorants à base d’éosine).
Les CQI KD-Col/ParaMyco/Selles-Lames (CQI KD-Col/PM/L) avec actuellement le CQI KD-Col/PM/L-Cryptosporidies constitué de lames avec 2 étalements de selles contenant des oocystes de Cryptosporidium sp. Ces CQI sont à utiliser pour la validation/vérification de la technique de Ziehl Neelsen modifiée.
Pour la maîtrise des techniques de concentration, Kalidiv propose aux LBM les CQI KD-TraceColor/Part et les CQI KD-TraceColor/PartInd.
Ils sont utilisés pour contrôler et valider le bon suivi des indications de la notice de la technique par le technicien et le bon fonctionnement de cette technique (diphasique ou filtration/centrifugation) pour la concentration des parasites dans les selles.
- Ces CQI contiennent :
- un traceur particulaire constitué de particules synthétiques colorées, dont la taille (25 à 100 μm) et la nature (hydrophile) miment celles de certains éléments parasitaires, tels que les œufs. Comme ces derniers, lorsque ces particules sont mélangées à une suspension de selles, elles sont retrouvées dans le culot après concentration avec les méthodes par sédimentation ou avec les méthodes diphasiques (ou physico-chimiques).
- un traceur indicateur est constitué́ de rouge de méthyle qui permet de contrôler le pH de la solution aqueuse (avant l’ajout du solvant) et la qualité́ de l’émulsion après addition du solvant organique, agitation et centrifugation. Ce colorant se localise alors dans la phase organique.
Deux CQI KD-TraceColor/Part sont proposés :
-
- Le CQI KD-TraceColor/PartB avec des particules colorées en bleu (10000±2000 particules par mL) pour les techniques qui utilisent une phase aqueuse non colorée (exemple la technique de Bailenger) ou une phase aqueuse colorée en rouge (exemple la technique du MIF).
- Le CQI KD-TraceColor/PartF avec des particules colorées en fuchsia (10000±2000 particules par mL) pour les techniques qui utilisent une phase aqueuse non colorée (exemple la technique de Bailenger) ou celles dont la lecture du culot est réalisée avec un contre colorant bleu.
- Deux CQI KD-TraceColor/Part-ind sont proposés aux LBM pour le contrôle et la validation des techniques de concentration des parasites avec des techniques diphasiques qui utilisent une phase aqueuse non colorée (exemple la technique de Bailenger) :
- Le CQI KD-TraceColor/PartB-Ind avec des particules colorées en bleu (10000±2000 particules par mL) en suspension dans une solution de rouge de méthyle.
- Le CQI KD-TraceColor/PartF-Ind avec des particules colorées en fuchsia (10000±2000 particules par mL) en suspension dans une solution de rouge de méthyle.

Nos Produits
-
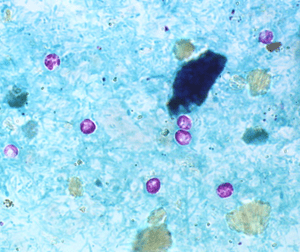
CQI Cryptosporidium – Lames (10) avec des oocystes de cryptosporidies
193,90 € H.T. -

CQI Cryptosporidium – Lames (5) avec des oocystes de cryptosporidies
106,60 € H.T. -

CQI formes végétatives (trophozoïtes) d’Entamoeba histolytica – 10 tubes
325,28 € H.T. -

CQI formes végétatives (trophozoïtes) d’Entamoeba histolytica – 5 tubes
178,40 € H.T. -
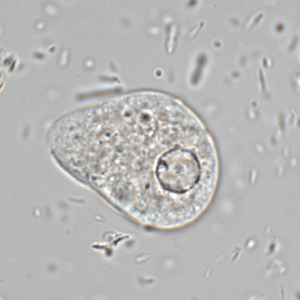
CQI formes végétatives (trophozoïtes) d’amibes du groupe d’E. histolytica-E. dispar-E. moshkovskii – 10 tubes
325,28 € H.T. -

CQI formes végétatives (trophozoïtes) d’amibes du groupe d’E. histolytica-E. dispar-E. moshkovskii – 5 tubes
178,40 € H.T. -
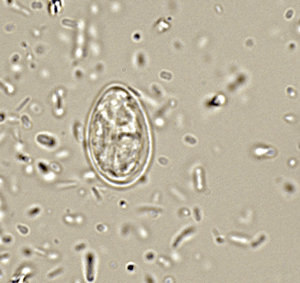
CQI kystes de Giardia duodenalis – 10 tubes
325,28 € H.T. -

CQI kystes de Giardia duodenalis – 5 tubes
178,40 € H.T. -
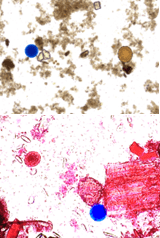
CQI KD-TraceColor/PartB – Particules bleues (1 flacon de 4 mL)
53,55 € H.T. -

CQI KD-TraceColor/PartB – Particules bleues (2 flacons de 4 mL)
97,51 € H.T. -

CQI KD-TraceColor/PartB – Particules bleues (1 flacon de 16 mL)
130,66 € H.T. -

CQI KD-TraceColor/PartB – Particules bleues (8 flacons de 16 mL)
653,72 € H.T. -

CQI KD-TraceColor/PartF – Particules fuchsia (1 flacon de 16 mL)
130,66 € H.T. -
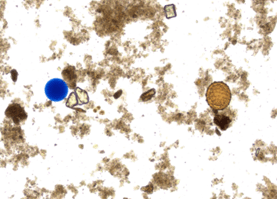
CQI KD-TraceColor/PartB-Ind – Particules bleues et rouge de méthyle (1 flacon de 16 mL)
135,05 € H.T. -

CQI KD-TraceColor/PartF-Ind – Particules fuchsia et rouge de méthyle (1 flacon de 16 mL)
135,05 € H.T.
